
Не стоит бояться перемен. Чаще всего они случаются именно в тот момент, когда они необходимы.
Конфуций
11(3) май 2020
В настоящее время при Международном союзе по теоретической и прикладной химии (IUPAC) организована специальная рабочая группа, целью которой является устранение путаницы относительно того, какой формат Периодической таблицы химических элементов считать «правильным». В связи с этим идут дискуссии о том, сколько и какие именно элементы нужно относить к 3-й группе *, а также о том, достаточно ли одной Периодической таблицы для отражения всех сторон Периодического закона, или для этого необходимо несколько разных таблиц .
В используемых сейчас Периодических таблицах все лантаноиды и актиноиды отнесены к третьей группе и, обычно, в виде двух таблиц, помещены отдельно от других элементов (Рис. 1).
* https://cen.acs.org/physical-chemistry/periodic-table/periodic-table-icon-chemists-still/97/i1?utm_source=Newsletter&utm_medium=Newsletter&utm_campaign=CEN
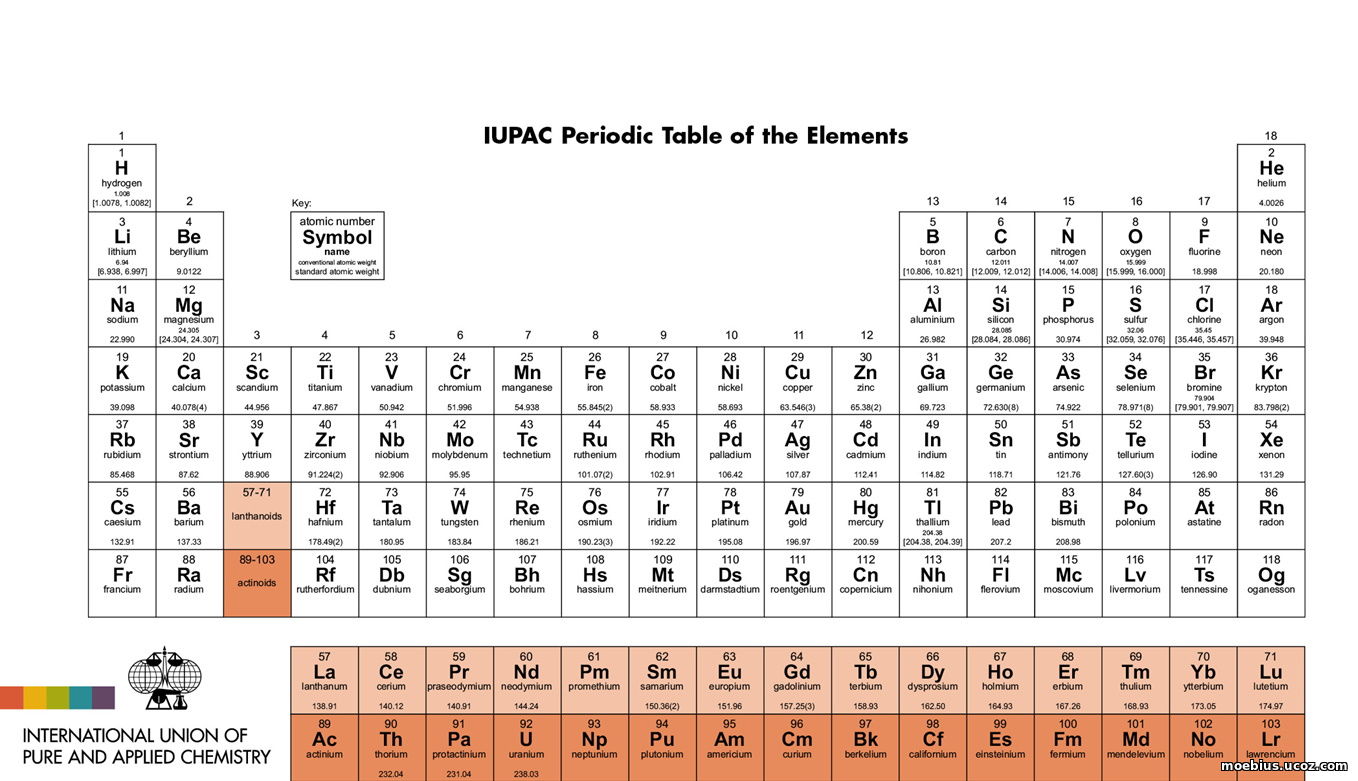
Рис. 1
Элементы «семейств» лантаноидов [ЛА] и актиноидов [АК] сходны между собой по некоторым химическим свойствам. Считается, что причиной этого сходства является то, что все они имеют на внешнем слое электронных оболочек атомов по 2 электрона.
При этом не принимают во внимание то, что внутренние слои электронных оболочек атомов этих элементов значительно различаются. В качестве примера, на рисунке 2 приведены условные схемы моделей распределения электронов по слоям для атомов четырех элементов одного «семейства»: лантана (57), самария (62), диспрозия (66) и иттербия (70).
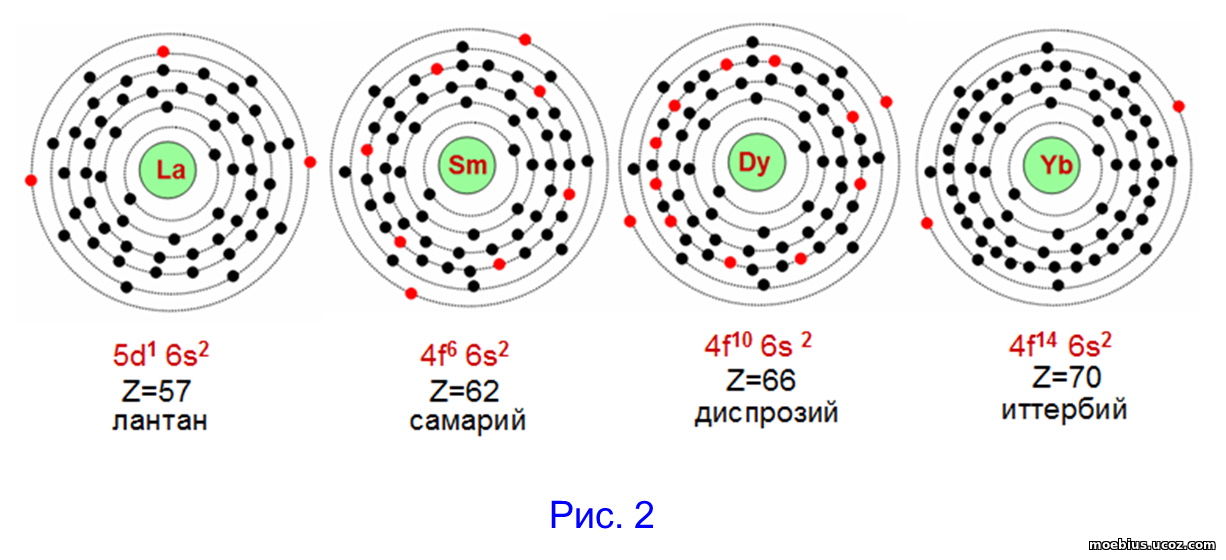
На рисунке 2 символы валентных электронов выделены, для наглядности, красным цветом. На рисунке видно, что атом лантана, задействовав три валентных электрона (5d1 6s2), исчерпывает свои возможности к образованию химических связей. В отличие от него, атомы самария и диспрозия, кроме 2-х валентных электронов на внешнем слое (6s2), имеют на незавершенных четвертых электронных слоях ещё шесть (4f6) и десять (4f10) валентных электронов, соответственно. Эти валентные электроны внутренних слоев, при определенных условиях, возможно, тоже могут быть задействованы в химических реакциях.
То есть, максимальные потенциальные количественные возможности атомов этих трех элементов образовывать химические связи отличаются между собой в разы, но сейчас все эти элементы помещены в одну (третью) группу таблицы, хотя они различны между собой как по свойствам, так и по областям применения.
Четвертый элемент, приведенный на рис. 2 - иттербий, тоже относится к семейству лантаноидов, но имеет не три, а всего два валентных электрона (6s2). Поэтому в таблице предлагаемого формата иттербий помещен не в третью, а во вторую группу элементов.
Следующий за иттербием лантаноид – лютеций с Z = 71, имеет, как и лантан, три валентных электрона (5d1 6s2), и оставлен в предлагаемой таблице в третьей группе элементов.
Чтобы количественно характеризовать максимальные потенциальные возможности участия элементов в химических реакциях, предлагается добавить для них дополнительный цифровой показатель - «суммарное количество валентных электронов» [СКВЭ].
Физический смысл этого показателя заключается в том, что максимальные потенциальные возможности элемента участвовать в химических реакциях количественно определяются не только валентными электронами, находящимися на внешнем слое электронной оболочки его атома, а всеми имеющимися у атома валентными электронами, потенциально способными участвовать в образовании химических связей, то есть их суммой.
В данной работе, наряду с электронами, которые находятся на внешнем слое электронной оболочки, к валентным относили также некоторые электроны незавершенных внутренних слоев.
О возможности отнесения электронов, располагающихся на незавершенных внутренних слоях к «валентным», судили, сравнивая энергетические параметры их орбиталей с энергетическими параметрами орбиталей электронов внешнего слоя электронной оболочки их атомов.
В качестве количественного цифрового показателя для сравнения использовали сумму величин главного (n) и орбитального (l ) квантовых чисел (n+l) групп, предложенную Э. Маделунгом (Erwin Madelung) и В. М. Клечковским**
** Клечковский В. М. Распределение атомных электронов и правило последовательного заполнения (n + l) групп. М., Атомиздат. 1968.
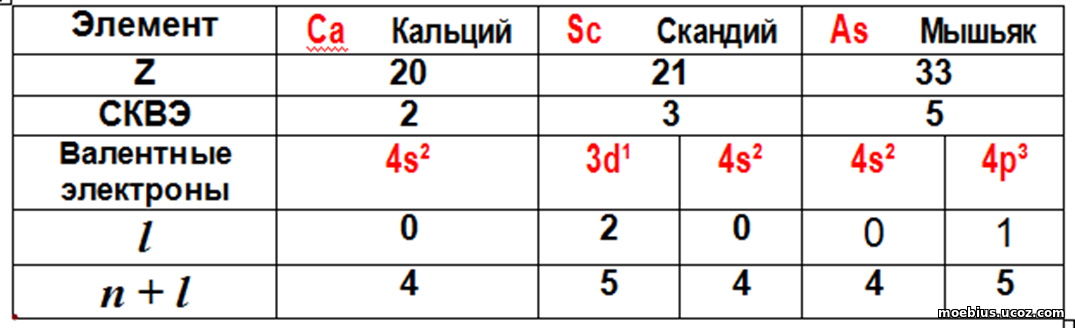
В качестве примера использования показателя (n+l ) для сравнения энергетических параметров электронов наружного и внутреннего слоев, рассмотрим несколько элементов 4-го периода таблицы.
По идентичности конфигураций валентных электронов элементы четвертого периода делятся на три группы:
4sХ - K(19), Ca (20), Cu (29) и Zn (30), где Х (количество электронов на орбитали 4s) = 1 или 2;
3dХ 4sY - восемь элементов, от скандия до никеля (Z = от 21 до 28, у которых Х = от 1 до 8, а Y = 1 или 2);
4s2 4pX - пять элементов, от галлия до брома (Z= от 31 до 35, а Х от 1 до 5)
В таблице 3 приведено по одному примеру из каждой «группы конфигураций» элементов 4-го периода.
Таблица 3.
На рис. 4 представлены систематизированные и обобщенные автором «группы конфигураций валентных электронов». В каждой «группе конфигураций» собраны элементы, у которых валентные электроны располагаются на одинаковых (частично на внешних и частично на незавершенных внутренних) слоях электронных оболочек атомов. Оказалось, что таких «групп конфигураций», в ПТ, включающей 124 элемента, всего 10: по одной у элементов четвертого и пятого периодов, две у элементов восьмого периода и по три у элементов шестого и седьмого периодов. Для каждой «группы конфигураций» в таблице 4 указаны Z , входящих в неё элементов, а также значения показателей «Х» и «Y», указывающие количество валентных электронов на орбиталях.
Атомы щелочных и щелочноземельных металлов, элементов у которых все валентные электроны находятся на внешнем электронном слое атомов, а также благородных газов и палладия не имеют незавершенных внутренних электронных слоев, поэтому эти элементы в таблицу не включены.
В таблице 5 представлено по одному элементу от каждой из десяти «групп конфигураций», приведены полные электронные конфигурации атомов элементов и показатели (n+l).
В таблице 5 видно, что электроны, находящиеся на орбиталях незавершенных внутренних слоев, всегда имеют показатель (n+l) больше, чем электроны, располагающиеся на орбиталях внешнего слоя электронной оболочки атома.
Но, поскольку у электронов с незавершенных внутренних слоев показатель (n+l) всегда больше, чем у валентных электронов внешнего слоя, то, вероятно, они тоже могут, при определенных условиях, принимать участие в образовании химических связей, то есть, как и электроны внешнего слоя, являются «валентными».
Следовательно, показатель: Суммарное количество валентных электронов - это общее число электронов, находящихся на внешнем слое электронной оболочки атома, то есть имеющих максимальную величину главного квантового числа «n», плюс число электронов, находящихся на незавершенных внутренних слоях, у которых показатель суммы главного и орбитального квантовых чисел (n+l) больше, чем у электронов внешнего слоя.
Рис. 5. Полные электронные конфигурации и величины показателей суммы главного и орбитального квантовых чисел (n+l ) групп.
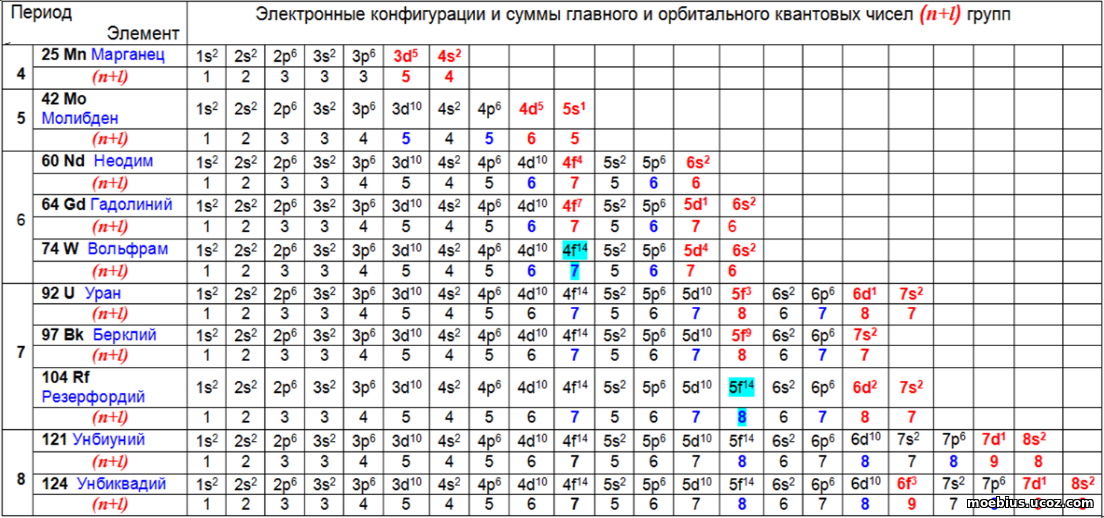
На рис.5 видно, что электроны незавершенных внутренних слоев всегда имеют показатель (n+l ) больше, чем электроны внешнего слоя. Они выделены шрифтом красного цвета.
Однако, на рис. 5 также видно, что и электроны завершенных внутренних слоев некоторых элементов (выделены голубым маркером) тоже имеют показатель (n+l ) больше, чем у электронов внешнего слоя. В таблице 6 это вольфрам (4f14) и резерфордий (5f14). Однако эти электроны не являются валентными, поскольку они располагаются на завершенных слоях.
При формулировании понятия «валентный электрон», в литературе обычно указывают, что валентными могут быть электроны: «не только внешнего слоя атома, но и часть электронов нижележащих слоев, если их энергия не сильно отличается от энергии электронов внешнего слоя».
При использовании показателя (n+l ) можно количественно конкретизировать эту формулировку: «Валентными являются электроны, находящиеся на внешнем слое оболочки атома и электроны незавершенных внутренних слоев у которых показатель суммы главного и орбитального квантовых чисел (n+l) больше, чем у электронов внешнего слоя».
Таким образом, чтобы электроны внутренних слоев атома были валентными, они должны удовлетворять двум условиям:
1) находиться на незавершенном слое;
2) иметь величину показателя ( n+l ) больше, чем у электронов внешнего слоя.
В настоящее время все ЛА и АК отнесены в Периодических таблицах к третьей группе элементов. Однако большинство из них не имеют такого комплекса свойств, который бы однозначно указывал на то, что их и нельзя помещать ни в какую другую группу.
Напротив, судя по данным литературы, большинство ЛА и АК наряду с некоторыми химическими свойствами присущими элементам их «семейств», одновременно имеют и часть химических свойств присущих элементам не третьей, а других групп. То есть, большинство ЛА и АК имеют двойственную природу, а значит, не обязательно должны быть помещены в третью группу ПТ. В связи с этим, вероятно, нужно вспомнить таблицу предложенную Д. И. Менделеевым в 1906 году, когда «семейств» ЛА и АК ещё не было (рис. 6).
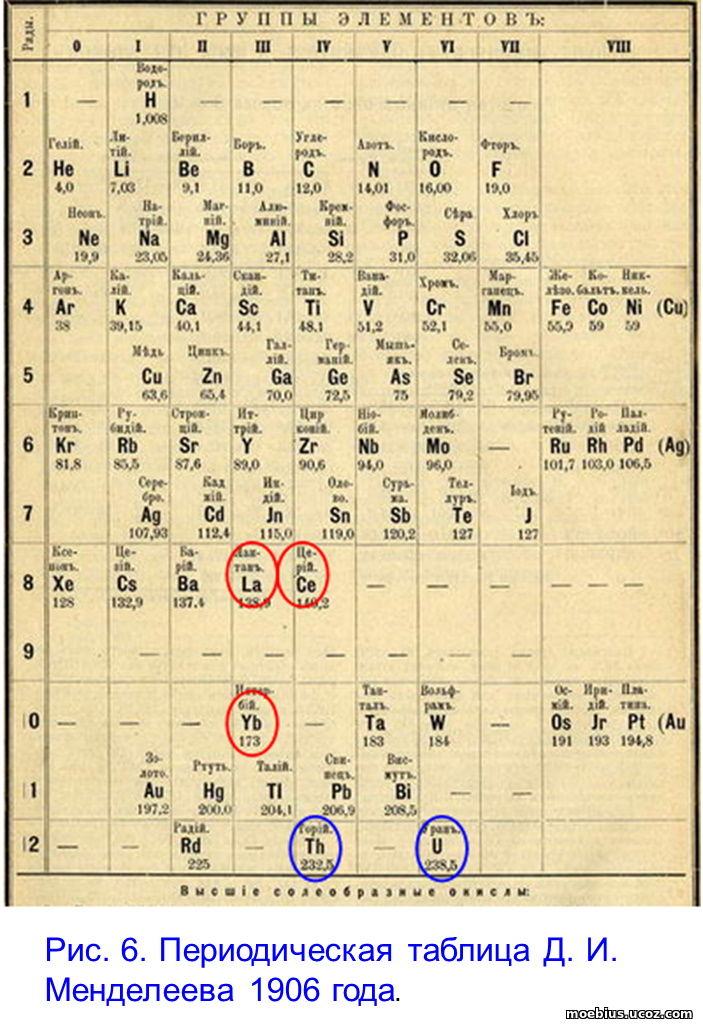
В таблице Д.И. Менделеева 1906 г. последовательность расстановки элементов определялась их атомными весами, а при размещении по группам предпочтение отдавалось химическим свойствам. Поэтому лантан и иттербий оказались в третьей группе, церий и торий в четвертой, а уран в шестой. На рисунке 6 эти пять элементов, относимых ныне к «семействам», обведены овалами.
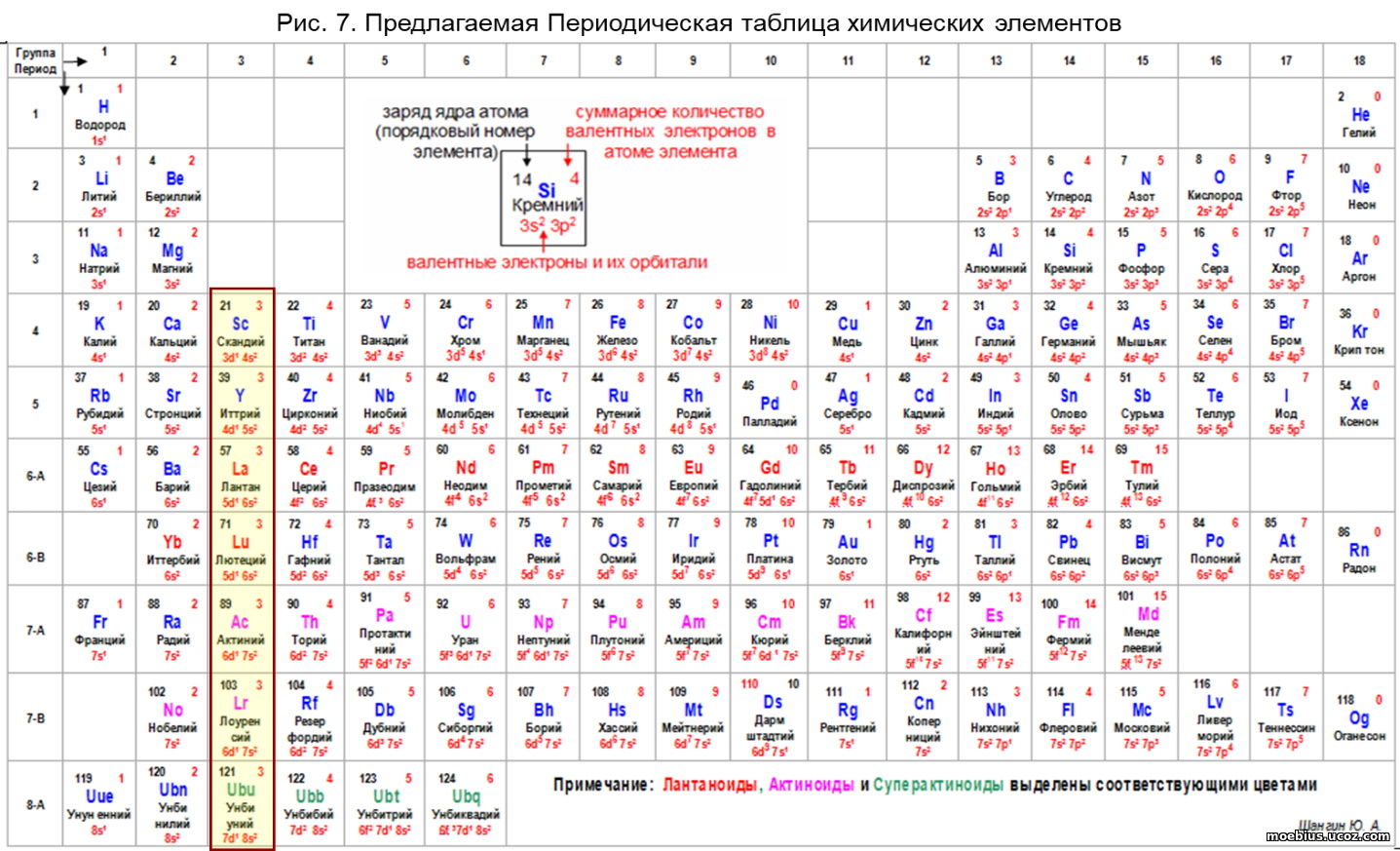
В таблице предлагаемого формата, рис. 7, четыре из пяти указанных элементов, «вернулись» в те же группы, в которые их поместил Д. И. Менделеев.
Исключение – иттербий, который в предлагаемой таблице помещен не в третью, а во вторую группу, в соответствии с конфигурацией электронной валентной оболочки его атома и показателем СКВЭ.
В Периодической таблице предлагаемого формата (рис. 7) в третьей группе осталось всего четыре из тридцати элементов «семейств»: лантан (57), лютеций (71), актиний (89) и лоуренсий (103).
Два примера двойственности свойств ЛА и АК
Протактиний (Ра) – актиноид, имеющий в соединениях три степени окисления +3, +4 и +5. При этом, в степенях окисления +3 и +4 он ведет себя как актиноид, а в наиболее характерной для него степени окисления +5, протактиний ведет себя подобно элементам пятой группы - ниобию и танталу:
● например, протактиний образует окисел Ра2О5 , аналогичный пятиокисям тантала (Ta2O5) и ниобия (Nb2O5);
● большинство соединений пятивалентного протактиния – галогениды, оксигалогениды и некоторые другие, по свойствам подобны соответствующим соединениям тантала;
● СКВЭ ниобия, тантала и протактиния = 5, а в соединениях протактиний, чаще всего, пятивалентен;
■ СКВЭ и валентность у актиния = 3.
● ● Таким образом, судя по химическим свойствам и показателю СКВЭ, место протактиния в пятой группе вместе с танталом и ниобием вполне обосновано.
Самарий (Sm) – лантаноид, имеющий некоторые химические свойства такие же, как у элемента восьмой группы – железа:
● на воздухе самарий и железо постепенно окисляются. При этом на их поверхности образуются оксиды, в том числе Fe2O3 и Sm2O3 ;
● при сплавлении смесей порошков самария и железа с халькогенами, образуются бинарные соединения этих элементов, в том числе: с серой (SmS и FeS), c селеном (SmSe и FeSe) и c теллуром (SmTe и FeTe);
● получены сходные по составу силициды (SmSi и FeSi), фосфиды (SmP и FeP) и арсениды (SmAs и FeAs) обеих металлов, а также их нитриды, карбиды и бориды;
● при нагревании самарий и железо взаимодействуют со всеми галогенами, образуя соответствующие хлориды, фториды, бромиды и иодиды;
● оба металла реагируют с разбавленными минеральными кислотами: соляной, серной и др.;
● СКВЭ у самария и у железа = 8;
■ СКВЭ у лантана = 3.
● ● Таким образом, самарий по своим химическим свойствам вполне обосновано может быть помещен в одну группу с железом.
ВЫВОДЫ
1.Предложен вариант Периодической таблицы химических элементов нового формата, в котором все элементы собраны в один общий блок, а не разделены на три отдельные части.
2.Показано, что лантаноиды и актиноиды двойственны по своей природе, следовательно, не все они должны быть помещены обязательно в третью группу таблицы.
3. Лантаноиды и актиноиды, перемещенные из третьей в другие группы логично вписались по показателям в таблицу предлагаемого формата, при этом некоторые из них по свойствам оказались ближе к элементам групп, в которые переместились, чем к элементам своих «семейств».
4. В третьей группе Периодической таблицы осталось из тридцати лантаноидов и актиноидов только четыре;
5. Иттербий и нобелий переместились из третьей группы во вторую.
Шангин Юрий Александрович,
E-mail: y.shangin@mail.ru | 






