
По-видимому, периодическому закону
будущее не грозит разрушением,
а только надстройка и развитее обещается.
Д. И. Менделеев.
Трактовка эксперимента – это дело вкуса.
Петр Капица.
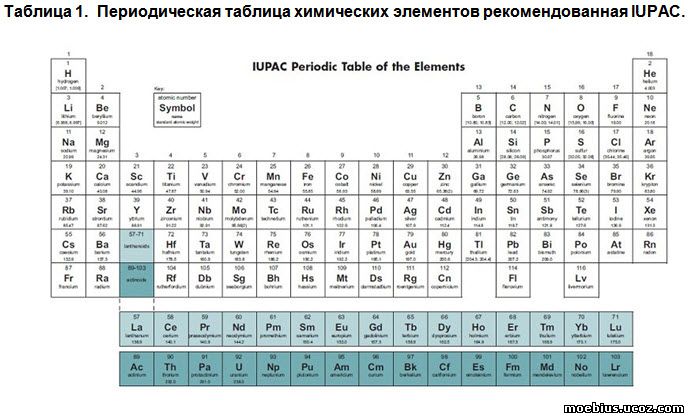
Периодическая таблица химических элементов является общепринятым способом отображения Периодического закона. В литературе описано несколько сотен форм периодической таблицы. В том числе в виде пирамид, диаграмм, спиралей, различных объёмных фигур и др. Естественно, что во всех случаях используется один и тот же фактический материал, но изложенный в различных формах и сочетаниях. Элементы располагают в порядке возрастания заряда ядер их атомов, а химические свойства элементов обычно объясняют, базируясь на строении электронных оболочек атомов и распределении в них валентных электронов.
Целью всех этих работ является стремление создать таблицу такой формы, в которой расположение элементов позволяло бы наиболее просто, доступно, а главное обоснованно видеть логику их размещения по группам и периодам. Ведь именно наглядность таблицы делает её убедительной и позволяет прогнозировать показатели новых, в том числе и пока неизвестных, элементов, базируясь на свойствах уже известных. В настоящее время чаще всего используется «Длиннопериодная форма периодической системы химических элементов», утверждённая в 1989 г. Международным союзом теоретической и прикладной химии (IUPAC) в качестве основной, в которой все элементы поделены на 18 групп (табл. 1). В этом варианте компоновки таблицы лантаноиды и актиноиды вынесены из её «основной» части, и в виде «отдельной» таблички отнесены к третьей группе элементов. Автор использовал таблицу IUPAC в качестве базовой.
В данной статье предлагается ещё один вариант таблицы, в форме, которая, по мнению автора, более наглядна и обоснована, чем другие. По крайней мере, она наглядней тех вариантов, которые автор смог найти в литературе. Полезность предлагаемой таблицы заключается в том, что она позволяет прогнозировать строение валентных оболочек атомов малоизученных и даже пока ещё не синтезированных элементов более наглядно и обоснованно, чем существующие таблицы, а также уточняет расположение в таблице нескольких лантаноидов и актиноидов (табл. 2).
Статья написана, на основе данных взятых из литературы и электронных носителей информации [1- 14].
В современных периодических таблицах в качестве основного критерия, определяющего группу, в которой размещается элемент, являются его химические свойства и количество электронов, располагающихся на внешнем энергетическом уровне. Именно находящиеся на нем электроны обычно называют валентными, то есть электронами, определяющими поведение атома в химических реакциях. Электроны, находящиеся на внутренних оболочках, реже принимают во внимание. При этом исходят из того, что электроны внутренних оболочек имеют, большей частью, меньшую энергию, чем электроны внешней оболочки. Однако известно, что некоторые электроны внутренних оболочек с подуровней d и f могут иметь энергию большую, чем электроны подуровня s внешней оболочки, что делает их валентными.
В отличие от имеющихся в литературе периодических таблиц, предлагаемая таблица содержит, в качестве дополнительной информации, сведения о СУММАРНОМ количестве валентных электронов. К валентным электронам автор относит электроны находящиеся не только на верхнем энергетическом уровне, но и находящиеся на незавершенных внутренних слоях. Введение именно этого показателя позволило увидеть в таблице то, что без него заметить было сложно.
При составлении таблицы 2, автор обратил внимание на то, что СУММАРНОЕ количество валентных электронов на внешней оболочке атомов плюс валентных электронов на ближайших внутренних оболочках в атомах всегда равно либо номеру группы, в которой располагается элемент, либо номеру группы минус десять. Исключением являются инертные газы.
Лантаноиды, актиноиды и суперактиноиды по указанному признаку (суммарному числу валентных электронов) органично вписываются в соответствующие группы шестого и седьмого периодов предлагаемой таблицы, На этом основании они перенесены из дополнения к таблице в её основную часть.
 
Первые пять периодов предлагаемой таблицы полностью совпадают с длиннопериодной таблицей утвержденной IUPAC. Шестой и седьмой периоды предлагаемой таблицы увеличены и разделены на две части (А и В) каждый. Размер этих периодов увеличен для того, что бы в них могли разместиться лантаноиды и актиноиды. Кроме того, появился восьмой период для суперактиноидов.
Показатели элементов, находящихся в частях «В» шестого и седьмого периодов предлагаемой таблицы, по суммарному количеству валентных электронов и их расположению на внешних и на незавершенных внутренних электронных слоях атомов коррелируют с аналогичными показателями элементов предыдущих периодов, несмотря на то, что в таблицу введены лантаноиды и актиноиды.
Эти две группы элементов обычно располагают в виде отдельной таблички, помещаемой ниже «основной» части таблицы. Это обусловлено двойственностью их показателей. С одной стороны, если располагать лантаноиды и актиноиды в соответствии с величинами зарядов атомных ядер, они должны бы изначально находиться в «основной» части таблицы. С другой стороны, все лантаноиды имеют валентность 3+, а некоторые из них, кроме того, ещё 2+ или 4+, что не вписывается в общую логику существующей таблицы 1. Ну и, кроме того, в «основной» части таблицы рекомендованной IUPAC для них попросту нет места. В результате их выделили в отдельную табличку, целиком относящуюся к третьей группе элементов.
У актиноидов разброс валентностей ещё больше, чем у лантаноидов, и они, по этому показателю, тоже не вписываются в «основную часть» периодической таблицы 1. Видимо поэтому, их также отнесли к третьей группе элементов.
Но, если в качестве одной из характеристик элементов рассматривать СУММАРНОЕ количество валентных электронов, то картина меняется. С учетом этого фактора, все лантаноиды и актиноиды логично укладываются в соответствующие группы увеличенных шестого и седьмого периодов.
Однако, этот же добавленный показатель суммарного количества валентных электронов делает необходимым по-другому разместить элементы внутри увеличившихся периодов, разделив их на две части. Первые 13 элементов лантаноидов и актиноидов размещаются в верхних частях периодов (А), а два оставшихся в нижних (В). При таком размещении, во всех группах периодической таблицы, у большей части элементов, включая лантаноиды и актиноиды, прослеживаются монотонные зависимости изменения конфигураций валентных оболочек.
Расстановка элементов в периодической таблице с учетом суммарного количества валентных электронов потребовала перемещения некоторых элементов в другие группы. В частности, иттербий (70) и нобелий (102) переместились из 16 группы во 2-ю, а лютеций (71) и лоуренсий (103) из 17 группы в третью.
Автор считает такое перемещение правомерным, потому что после перемещения этих элементов конфигурации их валентных оболочек стали логично вписываться в монотонные ряды изменения этого показателя внутри соответствующих групп (таблицы 3 и 4).

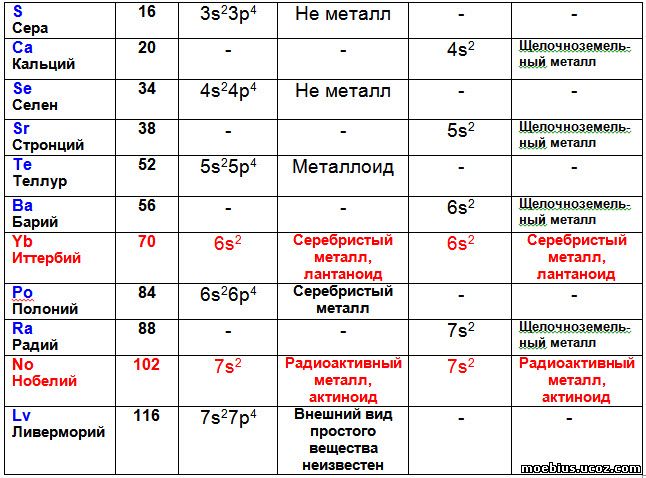
В таблице 3 видно, что иттербий и нобелий, судя по строению их валентных оболочек, должны располагаться не в 16, а во второй группе периодической системы. Возможно, что в последующем правомерность такого перемещения будет подтверждена, если будет установлено, что иттербий и нобелий имеют свойства щелочноземельных металлов.
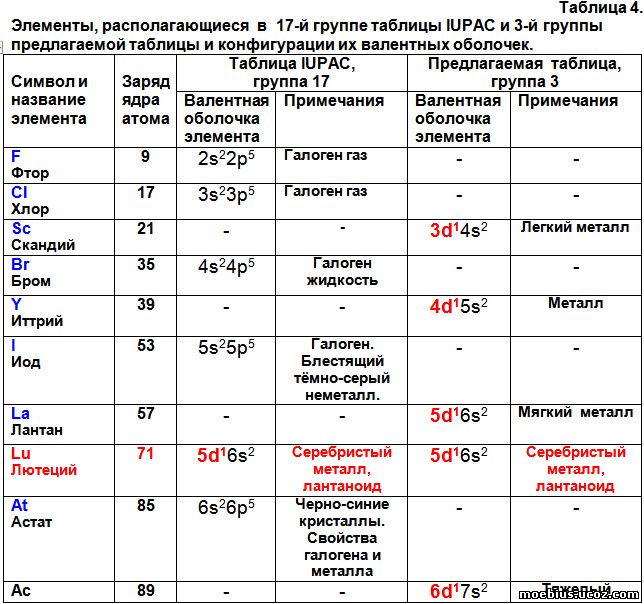
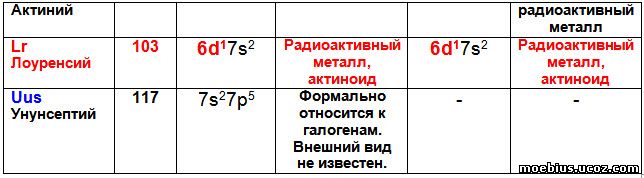
В таблице 4 видно, что лютеций и лоуренсий, судя по строению их валентных оболочек и химическим свойствам, не должны располагаться в 17-й группе периодической системы. А в третьей группе их расположение логично и обосновано.
После вышеуказанных перестановок элементов, в нижних частях (В) 6-го и 7-го периодов отсутствуют элементы первой группы, а в верхних частях (А) этих же периодов отсутствуют три последних элемента.
Вероятных причин этого может быть несколько. Во-первых, надо иметь в виду, что существующая сегодня модель строения атома, это - всего лишь «модель» такого сложного природного явления, каким является атом. Поэтому к существующей сегодня модели атома, вероятно, не следует относиться как к не подлежащей сомнению истине. Возможно также, что она прекрасно подходит для объяснения показателей элементов природного происхождения, но не полностью подходит для искусственно синтезированных и радиоактивных элементов.
Во- вторых, не исключено, что есть элементы, которые пока невозможно даже синтезировать в земных условиях, но которые, возможно, совершенно естественным образом существуют в условиях другой гравитации, давления, других магнитных полей и ещё каких- нибудь факторов, о которых мы даже не подозреваем.
В предлагаемой форме Периодической таблицы видно, что максимальное суммарное количество валентных электронов у большинства из известных химических элементов не превышает десяти. Исключениями являются 5 лантаноидов и 5 актиноидов. Вследствие этого, во всех периодах предлагаемой таблицы, кроме 6-А и 7-А, отсчет количества валентных электронов, начиная с 11 группы, снова начинается с единицы.
Предлагаемая таблица позволяет увидеть интересную связь между величинами зарядов ядер атомов элементов и суммарным количеством валентных электронов у них. Во всяком случае, автор не нашел в литературе описание таких зависимостей. У элементов, имеющих заряд ядра атома выражаемый четным числом, суммарное количество валентных электронов тоже всегда четное и равно либо номеру группы периодической системы, в которой располагаются элементы, либо номеру группы минус десять. Эти элементы всегда находятся в группах, имеющих четные номера.
У химических элементов, имеющих заряд ядра, выражаемый нечетным числом все вышеперечисленные признаки, выражаются нечетными цифрами. Вышесказанное относится также к лантаноидам, актиноидам и, по-видимому, к суперактиноидам.
Эти зависимости слишком многочисленны, что бы быть случайными. Не исключено также, что этот фактор (четный – нечетный) каким-то образом проявляется, например, на строении молекул веществ или комплексных соединений, в которые входят эти элементы. Можно так же предположить, что подобная связь между величинами зарядов ядер атомов элементов и суммарным количеством валентных электронов у них является одной из закономерностей строения атомов.
Если посмотреть, как изменяются конфигурации валентных оболочек элементов внутри групп, после того как в «основную» таблицу включили лантаноиды и актиноиды, то увидим следующее.
1) Конфигурации валентных оболочек всех элементов 1, 2, 3, 16, 17 и 18-й групп образуют правильные, монотонно изменяющиеся ряды.
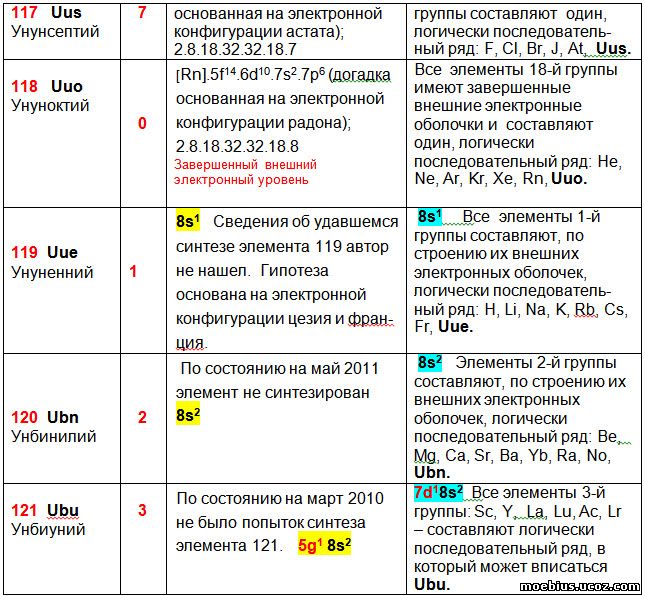
Например, элементы второй группы - Иттербий (70 - лантаноид) и Нобелий (102 - актиноид) по строению валентных оболочек составляют общий ряд с Бериллием (4), Магнием (12), Кальцием (20), Стронцием (38), Барием (56) и Радием (88). На основании этого можно предположить, что когда будет получен элемент с зарядом ядра атома 120, то он будет иметь два валентных электрона, расположенных на орбитали 8s², потому что будет логическим продолжением этого ряда.
Аналогично, элементы третьей группы - Скандий (21), Иттрий (39), Лантан (57), Лютеций (71- лантаноид), Актиний (89) и Лоуренсий (103 – актиноид), по строению их валентных оболочек образуют один монотонно изменяющийся ряд. Литературные данные о строении валентной оболочки Лоуренсия противоречивы: в одном случае они указаны как 7s² 7p¹, а в другом - как 6d¹7s². Автор включил в предлагаемую периодическую таблицу второй вариант, поскольку он совпадает с логикой изменения валентных оболочек всех остальных элементов третьей группы новой таблицы. Можно предположить, что когда будет получен элемент с зарядом ядра атома 121 (суперактиноид), то он будет иметь три валентных электрона, расположенных на орбиталях 7d¹ 8s², потому что будет продолжением этого ряда.
2) Конфигурации валентных оболочек элементов 7, 11, 12, 13, 14, и 15-й групп образуют монотонно изменяющиеся ряды, за исключением лантаноидов и актиноидов. В 4-ой группе имеется только одно исключение - Церий (58 - лантаноид).
3) Конфигурации валентных оболочек элементов расположенных в 5, 6, 8, 9 и 10-ой группах, разделяются на несколько подгрупп.
3.1) Элементы пятой группы, по идентичности строения валентных оболочек, делятся на четыре подгруппы:
- Ванадий (23), Тантал (73) и Дубний (105).
- Ниобий (41).
- Празеодим (59 - лантаноид).
- Протактиний (91 - актиноид).
Вероятно, идентичную протактинию валентную оболочку будет иметь элемент 123 – Ubt (унбитрий).
3.2) Элементы шестой группы, по идентичности строения валентных оболочек, делятся на четыре подгруппы:
- Хром (24), и Молибден (42).
- Неодим (60 - лантаноид).
- Вольфрам (74) и Сиборгий (106).
- Уран (92 - актиноид).
Вероятно, идентичную урану валентную оболочку будет иметь элемент 124 – Ubg (унбиквадий).
3.3) Элементы восьмой группы, по идентичности строения валентных оболочек, делятся на три подгруппы:
- Железо (26), Осмий (76) и Хассий (108).
- Рутений (44).
- Самарий (62 - лантаноид) и Плутоний (94- актиноид).
Вероятно, идентичную самарию и плутонию валентную оболочку будет иметь элемент 126 – Ubh.
3.4) Элементы девятой группы, по идентичности строения валентных оболочек, делятся на три подгруппы:
- Кобальт (27), Иридий (77) и Мейтнерий (109).
- Родий (45).
- Европий (63 - лантаноид) и Америций (95 - актиноид).
Вероятно, идентичную европию и америцию конфигурацию валентной оболочки будет иметь элемент 127.
3.5) Элементы десятой группы, по идентичности строения их валентных оболочек, делятся на четыре подгруппы:
- Никель (28).
- Палладий (46).
- Платина (78) и Дармштадтий (110).
- Гадолиний (64 - лантаноид) и Кюрий (96 - актиноид).
Вероятно, идентичную гадолинию и кюрию валентную оболочку будет иметь элемент 128.
Таким образом, после перенесения лантаноидов и актиноидов в «основную» часть таблицы группы стали более полными, а часть добавленных элементов, по конфигурации своих валентных оболочек, логично вписалась в новую таблицу.
Однако в предлагаемой периодической таблице имеются области, где, как и во всех других вариантах периодических таблиц, горизонтальное направление расположения элементов более значимо и показательно, чем вертикальное. Это относится к пятому периоду таблицы, а также к верхним строкам 6-го и 7-го периодов, где располагается большая часть лантаноидов и актиноидов.
Картина изменения строения валентных оболочек элементов внутри периодов, после того как в «основную» таблицу включили лантаноиды и актиноиды, выглядит следующим образом.
Первые пять периодов остались без изменений. Шестой и седьмой периоды увеличились на 15 элементов каждый и стали занимать по две строки - «А» и «В». Восьмой период, условно, увеличен на 6 элементов.
Рассматривая периоды с точки зрения строения электронных оболочек составляющих их элементов, мы видим, что периоды 4, 5, 6-В и 7-В состоят из двух частей каждый. Одна часть (левая) включает элементы с первой по 10-ю группу, а вторая часть (правая) с 11 по 18-ю группу. Во всех этих периодах, элементы 1-й и 2-й групп имеют валентные электроны только на s- орбиталях внешнего энергетического слоя. У большинства элементов, находящихся в группах с 3-й по 10-ю, идет монотонное заполнение электронами d-орбитали ближайшего к наружному энергетического слоя.
Большинство элементов 11-й и 12-й групп имеют валентные электроны только на s- орбиталях внешнего энергетического слоя. С 13-й по 18-ю группу у большинства элементов идет монотонное заполнение электронами p- орбитали наружного энергетического слоя. Лантаноиды и актиноиды, находящиеся в периодах 6-В и 7-В также вписываются в эту схему строения валентных оболочек.
Электронные конфигурации атомов элементов входящих в периоды 6-А и 7-А значительно отличаются от выше рассмотренных. Количество валентных электронов, у них может достигать пятнадцати. Это обусловлено тем, что в валентные оболочки большинства из находящихся в них элементов вовлечены электроны с f- орбиталей внутренних слоев.
Валентные оболочки первых трех групп периода 6-А и четырех групп периода 7-А, такие же, как у соответствующих им элементов тех же групп периодов 6-В и 7-В. В эти группы входят как обычные элементы, так и лантаноиды и актиноиды. У всех последующих элементов этих периодов идет постепенное заполнение валентными электронами 4f- орбиталей в периоде 6-А и 5f- орбиталей в периоде 7А. Кроме того, у некоторых из элементов наряду с f- орбиталями, новые валентные электроны появляются и на d-орбиталях.
Возможно, валентные оболочки элементов периода 8-А, могут быть близки по своему строению к элементам тех же групп периодов 6-А и 7-А.
В пятом периоде имеется несколько элементов, конфигурации валентных оболочек которых не вписываются в ряды монотонно изменяющихся параметров электронных оболочек соответствующих групп. Это: Ниобий (41), Рутений (44), Родий (45) и Палладий (46). Указанные примеры ещё раз подтверждают давно известный факт, что общие закономерности периодической таблицы не являются абсолютными.
Считается, что реальная польза от любой формы периодической таблицы определяется возможностью её применения для прогнозирования каких-либо показателей новых элементов и уточнения показателей уже известных. С целью проверки возможности использования предлагаемой периодической таблицы для прогнозирования строения валентных оболочек новых элементов, построена таблица 5. В этой таблице сравниваются гипотетические варианты строения валентных оболочек имеющиеся в литературе с гипотетическими вариантами строения оболочек, получаемыми в соответствии с логикой предлагаемой новой таблицы.
В таблице 5 приведены прогнозируемые валентные оболочки малоизученных, искусственно синтезированных элементов. У некоторых из них, например, у Ха́ссия (Hs -108), Мейтнерия (Mt - 109) и Дармштадтия (Ds - 110) - неизвестен даже внешний вид простых веществ. Значительная часть элементов, например, Унбиуний (Ubu - 121), Унбитрий (Ubt - 123) и Унбипентий (Ubp - 125) пока не синтезирована.
Тем не менее, в литературе имеются гипотезы строения электронных оболочек этих элементов, которые приведены в столбце 3, таблицы 5. Все эти гипотезы базируются на использовании в качестве прототипов хорошо изученных элементов, относящихся к той же группе периодической системы, но имеющих меньший заряд ядра. При этом, в качестве прототипа использован только один элемент, находящийся в периоде предшествующем прогнозируемому элементу, как наиболее близкий ему по свойствам. Наглядно и просто сравнить электронную оболочку лантаноидов и актиноидов с другими элементами групп в которых они могут находиться, существующие периодические таблицы (в том числе и таблица IUPAC) не позволяют.
В столбце 4 таблицы 5 приведены гипотетические валентные оболочки атомов, прогнозируемые в соответствии с логикой предлагаемой в данной статье периодической таблицы.
Таблица 5
Сравнение гипотетических вариантов строения электронных оболочек атомов элементов, приведенные в литературе и следующие из логики предлагаемой периодической таблицы. В таблице рассматриваются элементы, показатели которых не считаются окончательно установленными.
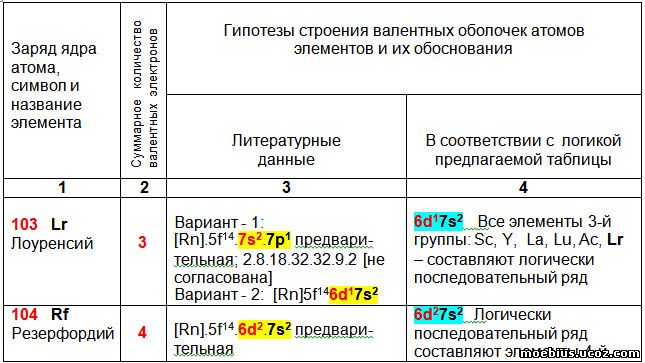
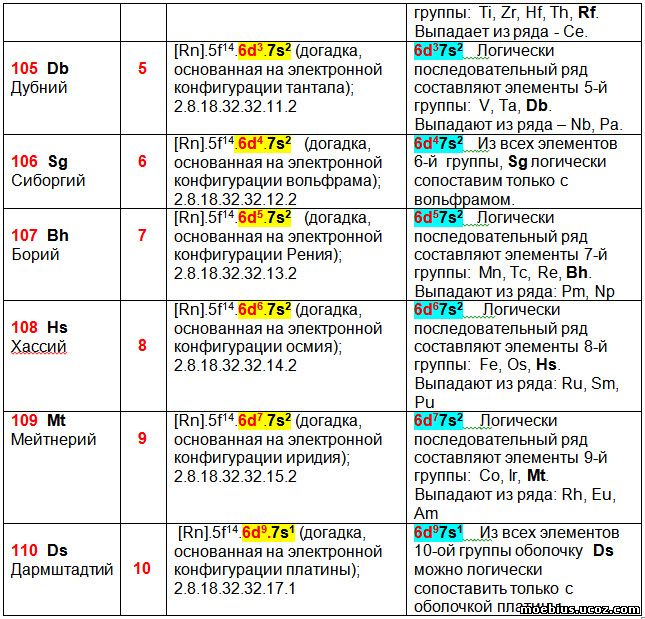



В таблице 5 видно, что с 103 по 120 элемент строение гипотетических электронных оболочек в столбцах 3 и 4 полностью совпадает.
Однако, этот одинаковый конечный результат достигнут разными способами. В столбце 4 строение гипотетических валентных оболочек новых элементов является логическим продолжением строения ВСЕХ других элементов группы (1, 2, 3, 16, 17 и18-я группы), или хотя бы нескольких элементов (4, 5, 7, 8, 9, 11, 12, 13, 14 и 15-я группы). По мнению автора, это является более наглядным и убедительным, чем использование в качестве прототипа всего одного элемента, как это сделано в столбце 3.
В столбце 4, исключением являются 6-я и 10-я группы. В 6-ой группе конфигурацию оболочки Sg (Сиборгий- 106) можно сравнить только с вольфрамом, а в 10-й группе аналогичную зависимость можно провести между Ds (Дармштадтий - 110) и платиной.
У элементов 121 – 126 гипотезы конфигураций валентных оболочек, приведенные в столбцах 3 и 4, отличаются. В обоих случаях внешние электронные оболочки всех этих элементов приходятся на орбитали 8s2. Однако гипотезы строения ближайших к ним внутренних орбиталей разные.
В столбце 3 гипотезы строения электронных оболочек построены на предположении, что элементы 121 - 126 будут принадлежать к новой группе - g-элементам. В этом случае, ожидаемая электронная конфигурация у них может быть [Uuo] 5g6 8s2, хотя из-за близости энергий, электроны, вероятно, смогут переходить с 5g-орбитали на 7d-орбиталь.
В столбце 4 гипотезы строения электронных оболочек элементов 121 – 126 рассматриваются как возможный вариант продолжения увеличения количества энергетических слоев у аналогичных элементов тех же групп, расположенных в периодической таблице выше них.
В Ы В О Д Ы.
1. Создан вариант периодической таблицы химических элементов, в котором ВСЕ элементы логично и обоснованно распределены по восемнадцати группам, в соответствии с СУММАРНЫМ количеством валентных электронов, находящихся как на верхнем, так и на незавершенных внутренних энергетических уровнях их атомов.
2. Установлено, что максимальное суммарное количество валентных электронов у любого из известных химических элементов не превышает пятнадцати. Численно оно равно либо номеру группы, в которой располагается элемент, либо номеру группы минус десять.
3. Показано, что лантаноиды и актиноиды по суммарному количеству валентных электронов, органично вписываются в соответствующие группы шестого и седьмого периодов предлагаемой периодической таблицы. На основании этого они перенесены из дополнения к таблице в её основную часть. Обновленные шестой и седьмой периоды увеличены и разделены на две части (А и В) каждый. Первые 13 элементов лантаноидов и актиноидов размещаются в верхних частях периодов (А), а два оставшихся элемента - в нижних (В).
4. Изменена расстановка некоторых элементов по группам с учетом суммарного количества валентных электронов. В результате четыре элемента: иттербий(70), лютеций(71), нобелий(102) и лоуренсий(103) – переместились из 16 и 17 групп во вторую и третью.
При этом конфигурации валентных оболочек перемещенных элементов логично вписались в монотонно изменяющиеся ряды этого показателя внутри соответствующих групп. Таким образом, предлагаемая таблица позволяет более обоснованно и логично распределить элементы по группам.
5. Установлено, что у элементов, имеющих заряд ядра атома выражаемый четным числом, суммарное количество валентных электронов всегда четное, а у элементов, имеющих заряд ядра атома выражаемый нечетным числом - нечетное.
6. Предлагаемая периодическая таблица обладает предсказательной силой. Она позволяет обоснованно и наглядно прогнозировать конфигурации электронных оболочек ещё не изученных и даже не синтезированных элементов. Спрогнозированные с её помощью гипотезы электронных оболочек элементов с зарядами ядер атомов от 103 до 120 совпадают с гипотезами других исследователей.
Литература и другие источники, использованные
при составлении таблицы.
1. Современная периодическая система элементов Д.И.Менделеева
2. Периодическая система химических элементов — Циклопедия
3. «Список химических элементов по электронной конфигурации» и Электронные формулы атомов химических элементов
4. «Таблица валентностей элементов»
Таблица валентностей химических элементов. DPVA.info ...
5. Химическая энциклопедия в 5 томах. Изд. Советская Энциклопедия, под ред. д. х. н. Кнунянца, год изд.: 1988-1998, с. 3120.
6. Периодическая система элементов — Периодическая система химических...
7. / Раритетные издания / Популярная библиотека химических элементов
8. Интерактивная таблица Менделеева
9. Некрасов Б. В. Курс общей химии. М., Госхимиздат. 1952. - 997с.
10. Григорович В. К. Металлическая связь и структура металлов. М.: Наука, 1988. – 296 с.
11. Потапов К. И. Спиральные модели периодической системы. СПб.: 2011. – 79 с.
12. Потеряхин В.А. Система химических элементов (история и современные проблемы). Уфа: гос. издат. науч.- техн. литерат. «Реактив». 1999. – 216 с.
13. Корольков Д.В., Скоробогатов Г.А. Основы теоретической химии. М.: Академия, 2004. – 352 с.
14. Строганов А. И., Сенин А. В. Строение электронных оболочек атомов и периодическая система элементов Д.И. Менделеева. Учебное пособие. Челябинск: Южно - Урал. гос. универ. 1999. – 35 с.
Шангин Юрий Александрович,
Санкт- Петербург,
E-mail: y.shangin@mail.ru
01 июня 2014г.
| 






